Ver entier épinglé
|
Le ver est anesthésié en le
plongeant dans une solution d'éthanol à 5 % jusqu'à
ce qu'il devienne flasque et aréactif.
Il est alors fixé à une planchette à dissection
par deux épingles enfoncées respectivement dans la tête
et en arrière du clitellum.
La dissection est destinée à prélever intact l’ensemble
jabot-gésier. |
| Inciser la paroi du corps avec des ciseaux
fins dans la région antérieure le long d’une ligne dorsale
allant de la tête à l’arrière du clitellum et écarter
les parois du corps avant de les épingler de part et d’autre de
l’incision. |

Ouverture de la paroi du corps
|
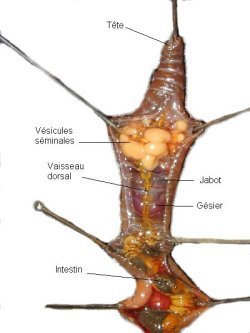
Résultat
|
Le tube digestif s’étend d’un bout à l’autre du corps.
De la bouche à l’anus, il comporte successivement le pharynx, l’œsophage,
le jabot et le gésier puis l’intestin.
Le jabot et le gésier sont situés en arrière des
vésicules séminales facilement identifiables une fois ouverte
la paroi de la région antérieure du corps.
Le jabot ne semble pas jouer de rôle important dans la digestion
tandis que le gésier qui contient des particules minérales
venues du sol assure le broyage des aliments par les contractions de son
épaisse paroi musculaire. |
| Un fil est passé sous l’extrémité
antérieure du jabot et un autre sous l’extrémité postérieure
du gésier. L’ensemble jabot-gésier est libéré
de ses attaches en incisant les dissépiments, cloisons transparentes
séparant les anneaux, puis chaque fil est ligaturé solidement
autour du tube digestif. |

Passage des fils
|

L'ensemble jabot-gésier isolé
|
L’ensemble jabot-gésier est alors extrait du corps en sectionnant
le tube digestif en avant et en arrière et en éliminant les
dernières adhérences. Il est placé dans un récipient
contenant le liquide de survie aéré
par un bulleur d’aquarium. |
|
|
|
L’enregistrement des contractions de l’ensemble jabot gésier
nécessite une cuve de survie constituée d’un tube rempli
de liquide physiologique aéré en
permanence avec une pompe d’aquarium. L’organe est fixé au fond
du tube par l’un des deux fils, l’autre fil étant fixé au
levier du transducteur de force.
Le levier est relié à un potentiomètre liquide
inclus dans un pont de mesure alimenté par une pile de telle sorte
que tout déplacement du levier se traduit par une variation proportionnelle
de la tension électrique. Les sorties du pont sont connectées
à une entrée de l’interface d’acquisition
pilotée par un logiciel généraliste.
Dans ces conditions, toute contraction de l’ensemble jabot-gésier
se traduit par une déflexion du tracé sur l’écran
de l’ordinateur.
L’ensemble jabot-gésier est d’abord placé dans la chambre
de survie remplie de liquide physiologique aéré dans le but
de mesurer la fréquence et l’amplitude des contractions spontanées
en l’absence de tout traitement. |

Montage utilisé
|

Détails du montage
|
Après la mise en place de l’organe dans la cuve, un temps de
récupération de quelques minutes doit lui être laissé
jusqu’à ce que des contractions spontanées et régulières
soient observées.
La tension mesurée est proportionnelle à l'intensité
des contractions et peut être convertie en unités conventionnelles
en étalonnant le capteur avec des poids appropriés.
La fréquence des contractions peut varier entre 2 et 10 Hz selon
les échantillons et varie également en fonction de la température. |
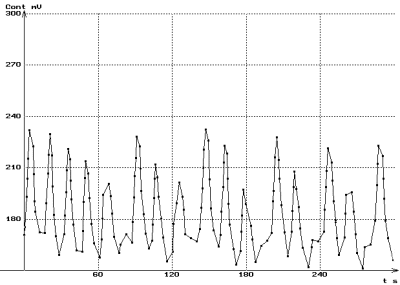
|
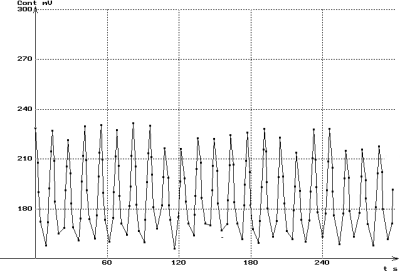
|
Contractions spontanées de l'ensemble jabot-gésier
(à gauche, immédiatement après la mise en place
de l'échantillon ; à droite, après quelques minutes
de repos.)
Noter la régularisation de la fréquence et de l'amplitude
des contractions après récupération.
|
| On peut alors tester l’action de
différents facteurs sur l’activité des muscles lisses qui
constituent l’essentiel de la paroi des organes isolés. Diverses
substances chimiques peuvent être testées ainsi que d’autres
types de stimulus comme un étirement brusque ou un choc électrique. |
-
Résultats
-
Action de l'acétylcholine
Une solution stock d'acétylcholine a été préparée
dans du liquide physiologique et des dilutions ont été réalisées
ensuite de façon à ce que l'addition d'un mL de solution
d'acétylcholine dans la cuve (contenant 30 mL de liquide physiologique)
donne des concentrations finales comprises entre 5 nmol.L-1
et 1,4 µmol.L-1.
Pour chaque mesure, la solution d'acétylcholine est ajoutée
après une à deux minutes d'enregistrement et elle est injectée
vivement dans le liquide physiologique avec une seringue de 1 mL de façon
à ce que le mélange s'effectue rapidement. L'enregistrement
est ensuite poursuivi pendant 5 à 10 minutes. Après l'enregistrement,
la cuve est vidangée et remplie de nouveau de liquide physiologique
et cette opération est répétée une seconde
fois pour bien rincer l'ensemble jabot-gésier jusqu'à ce
que la fréquence et l'amplitude des contractions reviennent à
leur valeur initiale.
Les différents enregistrements obtenus avec des concentrations
croissantes d'acétylcholine ont été superposés
de façon à en faciliter la lecture. Ils sont présentés
ci-dessous. |
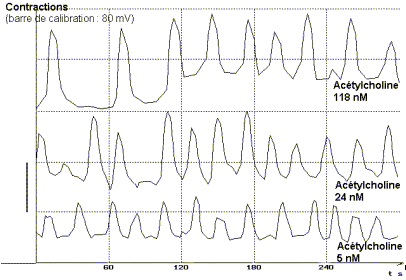
Addition d'acétylcholine à t = 90 s
|
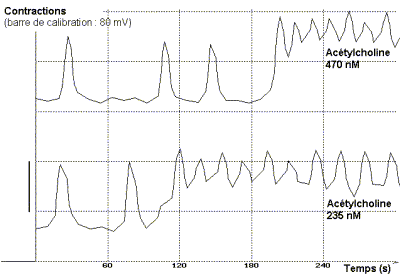
Addition d'acétylcholine
t = 90 s (235 nM) ; t = 120 s (470 nM)
|
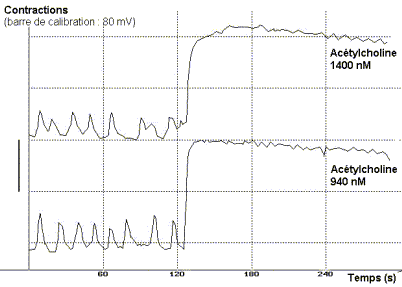
Addition d'acétylcholine à t = 120 s
|
On constate que l'addition de concentrations croissantes d'acétylcholine
dans le liquide physiologique augmente l'intensité et la fréquence
des contractions spontanées de l'ensemble jabot-gésier. L'action
de l'acétylcholine se manifeste à partir d'un seuil compris
entre 5 et 24 nm.L-1 et atteint un maximum à partir de
940 nmol.L-1, concentration conduisant au tétanos de
l'organe. Au delà de ce maximum une augmentation de la concentration
ne modifie plus la réponse.
L'acétylcholine exerce son action en augmentant à la
fois l'amplitude maximale de la contraction, le tonus de l'organe lors
de la relaxation et la fréquence des contractions. |
-
Construction de la courbe dose-réponse
Pour construire la courbe dose-réponse, on a utilisé l'effet
exercé sur le tonus de l'organe. Pour chaque concentration du neurotransmetteur
la différence entre la valeur minimale atteinte lors de la relaxation
de l'organe après addition d'acétylcholine et la valeur minimale
atteinte lors de la relaxation avant addition d'acétylcholine a
été calculée et reportée sur un graphique en
fonction de la concentration en acétylcholine.
Le graphique ci contre présente les résultats obtenus. |
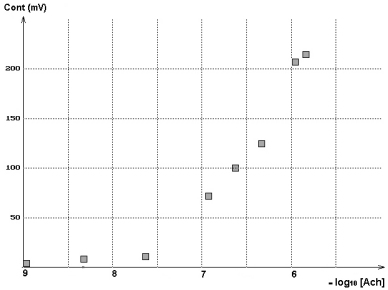
Courbe dose - réponse pour l'acétylcholine
|
Si l'acétylcholine est un neurotransmetteur physiologique au niveau
des muscles lisses de l'ensemble jabot-gésier, elle devrait être
associée avec une acétylcholinestérase comme c'est
le cas habituellement avec ce neurotransmetteur.
Dans ce cas, l'addition d'un inhibiteur de l'acétylcholinestérase
comme l'ésérine au liquide physiologique devrait se traduire
par un renforcement des contractions.
Les résultats ci-contre montrent qu'il en est bien ainsi lorsque
de l'ésérine à une concentration finale de 1mg.L-1
est ajoutée dans la cuve alors que l'action de l'acétylcholine
est en train de se dissiper. |
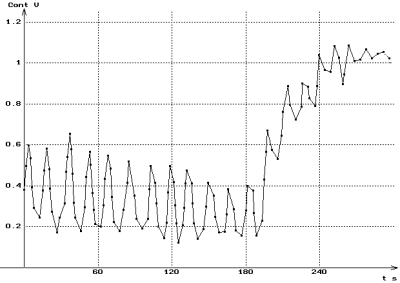
Addition d'ésérine à t = 180 s
|
|
|
L'ensemble jabot-gésier du ver de terre constitue un modèle
intéressant pour étudier, notamment en travaux pratiques,
l'action de diverses substances pharmacodynamiques sur le muscle lisse.
Les résultats obtenus montrent ainsi que l'acétylcholine
stimule l'activité du muscle lisse de ver de terre comme elle le
fait chez les vertébrés et que son action est renforcée
par la présence d'ésérine.
En utilisant d'autres neurotransmetteurs, leurs agonistes et leurs
antagonistes, il est possible de mener une caractérisation pharmacologique
plus précise de certains des neurotransmetteurs et des récepteurs
impliqués dans le fonctionnement de ces muscles.
Les expériences correspondantes et les résultats obtenus
sont présentés sur la page "Caractérisation
pharmacologique des récepteurs cholinergiques du tube digestif du
ver de terre".
D'autres résultats concernant l'action de diverses substances
pharmacodynamiques sont présentés à la page "Diversité
des récepteurs des muscles lisses dans le jabot-gésier du
ver de terre".
|
| ANNEXES |
|
-
Liquide physiologique
-
NaCl 7,1 g
-
KCl 0,3 g
-
NaHCO3 1,5 g
-
NaH2PO4 0,55 g
-
MgCl2 0,2 g
-
CaCl2 0,22 g
-
Glucose 1 g
Dissoudre dans un litre d’eau distillée et ajuster le pH à
7,3.
|
-
Interface et logiciel d'acquisition
|