| Accueil | B.Mol | Gen | T.P | Web |
| LA
REGULATION DU CYCLE CELLULAIRE |
Marie-Claude
Lebart, Jean Mariani
Gilles
Furelaud
Chapitre
4 - Le passage de G2 en M, c'est à dire le déclenchement
de la mitose (l'entrée en mitose) |
||
| sommaire : |
L'entrée en mitose, ou transition G2 / M, est sous le contrôle
du complexe Cycline B / Cdk1, et se réalise de manière brutale.
Or, on peut constater que la Cycline B est synthétisée pendant
une longue période du cycle, et que le complexe Cycline B / Cdk1 se forme
progressivement au cours des phases S et G2.
(Les courbes présentées montrent que pour les autres
complexes, il existe de la même façon une accumulation progressive,
en particulier pour la Cycline E / Cdk2 )
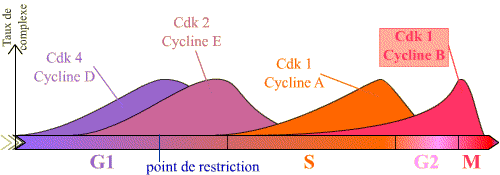
Abondance des complexes Cycline / Cdk au cours du cycle cellulaire.
L’axe donne la succession des complexes en fonction des phases
du cycle. Seuls les principaux complexes sont indiqués
Comment alors expliquer que l'activité du complexe Cycline B / Cdk1 débute brusquement, au moment de l'entrée en mitose ?
L'ensemble du processus peut être décomposé en trois temps :
Constitution d'un stock de Cycline B / Cdk 1 inactif (Pré-MPF)
La Cycline B s'accumule progressivement pendant les phases S et G2, ce qui
conduit à une accumulation graduelle du complexe au fur et à mesure
que la cellule approche de la mitose. La Cdk1 est alors phosphorylée
sur la thréonine 161 par la CAK (Cycline H / Cdk7), mais
reste inactive à cause de la phosphorylation de 2 acides aminés
voisins (tyrosine 15 et thréonine 14) par la protéine Wee-1. Ainsi,
quand la cellule atteint la fin de la phase G2, elle contient un abondant stock
de Cycline B / Cdk1 ( stock de pré-MPF inactif) prêt à agir
mais dont l’activité est réprimée par la présence
de 2 groupes phosphate qui bloquent la kinase.
Pré-MPF = Cycline B / Cdk1 Tr 161p, Tr 14p, Ty 15p
La cycline B est synthétisée en permanence mais dégradée (APC-PR) de M à S
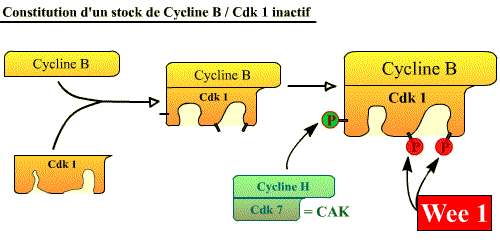
Stock de Cycline B / Cdk 1 inactif. Cdk 1 s'associe à
la cycline B, et est phosphorylée par CAK et Wee 1. [Cliquez
sur la figure pour accéder à une explication
animée]
L'activation du stock de Cycline B / Cdk1 est le résultat d'une série de réactions interdépendantes :
Lorsque la réplication est terminée, la phosphatase Cdc25 n'est
plus séquestrée dans le cytoplasme et passe dans le noyau, et
en fin de phase G2, la phosphatase Cdc 25 est activée,
probablement par phosphorylation par la kinase Polo. Cdc 25 a alors pour action
d'enlever les deux phosphates inhibiteurs de Cycline B / Cdk 1. Ceci permet
l'activation d'une petite partie du stock de Cycline B / Cdk1 .
Cdk 1 peut alors phosphoryler Cdc 25 (sur un site différent de celui
de la kinase Polo). Cette phosphorylation active Cdc 25 : Cycline B / Cdk 1
active donc son propre activateur (Processus d'auto-activation).
Dans le même temps, Cycline B / Cdk 1phosphoryle Wee 1, inhibant cette
protéine : Cycline B / Cdk1 inhibe donc son propre inhibiteur.
Ce double mécanisme de rétrocontrôle positif permet d'obtenir rapidement et de façon irréversible une grande quantité de complexes Cycline B / Cdk1 actifs (Feed-back positif).
Modalités proposées pour expliquer l'activation brutale du stock
de Cycline B / Cdk 1 .[Cliquez ici
pour l'animation sur une page indépendante]
Selon ce mécanisme, une activation partielle de Cdc 25 par la kinase Polo permet l’activation d’une sous population de complexes Cycline B / Cdk 1 qui, par la suite, phosphoryle plus de Cdc-25 et de Wee-1. Ceci permet plus de déphosphorylation de cycline B / Cdk1 et aboutit à une très rapide activation de tous les complexes Cycline B / Cdk 1 dans la cellule.
Les complexes Cycline B / Cdk 1, une fois activés, permettent l'entrée
en mitose. Pour cela, ils interviennent en déclenchant un certain nombre
de phénomènes qui prennent place au début de la mitose,
c'est à dire en prophase.
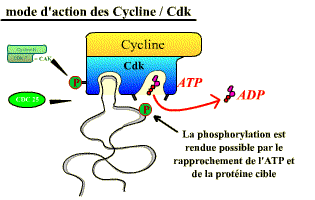
Action d'une Cycline / Cdk activée. [Cliquez
sur la figure pour accéder à une explication
animée]
Les effets sur le cycle de l’activité de chaque complexe (ici Cycline B / Cdk1) dépendent donc des protéines cibles que chaque complexe phosphoryle.
Au début de la mitose, les complexes Cycline B / Cdk1 activés agissent en phosphorylant diverses protéines cibles. Parmi ces nombreuses protéines, on trouve :
Globalement, l'activité kinase de ce complexe permet de provoquer de très nombreux évènements de la mitose :
Exemple : désorganisation de l’enveloppe nucléaire
La phosphorylation des lamines (filaments intermédiaires du noyau)
par la Cycline B / Cdk 1 au début de la mitose provoque leur dépolymérisation.
Or ces lamines étaient associées à l'enveloppe nucléaire,
et permettaient de la structurer. En conséquence, leur dépolymérisation
a pour effet de désorganiser l’enveloppe nucléaire qui se
disperse en petites vésicules. Certaines lamines (les lamines B) restent
ancrées dans les vésicules d'enveloppe nucléaire car elles
sont isoprénylées (ancre lipidique). Les lamines ont des séquences
de liaison aux chromosomes, ce qui facilite la reformation de l'enveloppe nucléaire
autour de ceux-ci en fin de mitose.
Le processus inverse a lieu à la télophase, en fin de mitose,
lorsque les lamines seront déphosphorylées.
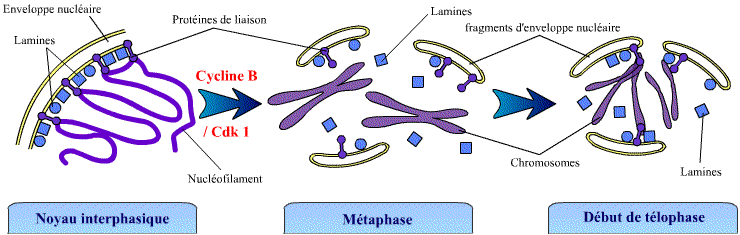
Dépolymérisation des lamines et désorganisation de l'enveloppe
nucléaire.
L’activation du complexe Cdk 1 / Cycline B nécessaire pour que l'entrée en mitose se réalise permet à la cellule de contrôler ce moment clé de son cycle cellulaire.
| 1 - Mise en évidence de l'existence d'un contrôle du cycle cellulaire | 5 - Le point de surveillance G2 / M | 9 - Le point de surveillance G1/S |
| 2 - La régulation de la succession des quatre phases du cycle par les Kinases cycline - dépendantes (Cdk) | 6 - Transition métaphase - anaphase et point de surveillance métaphase - anaphase | 10 - La phase S (à venir) |
| 3 - Mécanismes de surveillance contrôlant les transitions G1/S, G2/M et métaphase/anaphase | 7 - Comment une cellule en G0 peut rentrer en G1 | 11 - Conclusion |
| 4 - Le passage de G2 en M, c'est à dire le déclenchement de la mitose (l'entrée en mitose) | 8 - Le passage de G1 à la suite du cycle | |
| |
© Copyright "Biologie et Multimédia" | |
Mise
en ligne : juin 2004 |