| Accueil | B.Mol | Gen | T.P | Web |
| LA
REGULATION DU CYCLE CELLULAIRE |
Marie-Claude
Lebart, Jean Mariani
Gilles
Furelaud
Chapitre
2 - La régulation de la succession des quatre phases du cycle par
les complexes Cyclines - Cdk |
||
| sommaire : | |
Définition et mode d'action des Kinases cycline-dépendantes (Cdk)
Entre 1987 et 1990, le régulateur universel de l’entrée en mitose (le MPF) est caractérisé : c’est une kinase cycline-dépendante (Cdk) associée à une cycline. Entre 1990 et 2000, une douzaine de Cycline / Cdk sont décrites chez l’homme. Six d’entre elles interviennent dans le contrôle direct du déroulement du cycle cellulaire. Les Cdk forment des complexes hétérodimériques avec les cyclines, leurs sous unités régulatrices.
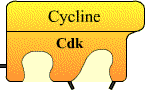
Une Cdk s'associe avec une cycline pour former un complexe.
La première Cdk mise en évidence fut la Cdk1 qui, associée à la cycline B, constitue le MPF :
Cycline B / Cdk1 = MPF
Les Cdk ne deviennent fonctionnelles que lorsqu’elles sont associées
à une cycline.
Les cyclines ne sont pas présentes pendant tout le cycle, elles apparaissent
puis disparaissent brusquement à des moments précis du cycle,
de façon périodique. Les Cdk peuvent donc être sous forme
activée ou désactivée, selon qu’elles sont associées
ou non à leur cycline. Mais nous verrons que d’autres activateurs
ou inhibiteurs des Cdk interviennent.
Les Cdk sont des sérine-thréonine kinases, enzymes qui catalysent la phosphorylation de protéines cibles ( = substrats) jouant un rôle dans les événements du cycle cellulaire (fragmentation de l’enveloppe nucléaire, compaction des chromosomes, réplication de l’ADN ….), ou dans l'avancement du cycle. Leur activité consiste à transférer le groupement γ-phosphate de l’ATP sur une sérine ou une thréonine, présentes dans les protéines cibles, à condition que ces acides aminés soient dans une séquence d'acides aminés caractéristique (séquence consensus) spécifiquement reconnue par la kinase (exemple : Ser/Thr-Pro-X-Arg/Lys). .
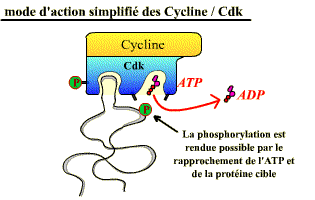
Le complexe Cycline / Cdk agit en phosphorylant une protéine.
De cette phosphorylation, il résulte un changement de conformation des
protéines cibles, ce qui entraîne des propriétés
nouvelles pour ces dernières (activation, inhibition, changement de partenaire
d'intéraction...).
Les cyclines n’ont pas d’activité enzymatique, ce sont des
protéines régulatrices nécessaires aux Cdk pour qu’elles
soient enzymatiquement actives
Différents complexes Cycline / Cdk interviennent à des moments précis du cycle cellulaire
Le cycle cellulaire est contrôlé par au moins 6 complexes Cycline / Cdk différents qui interviennent à des moments précis du cycle cellulaire. (Chaque Cdk agit sur des substrats définis)
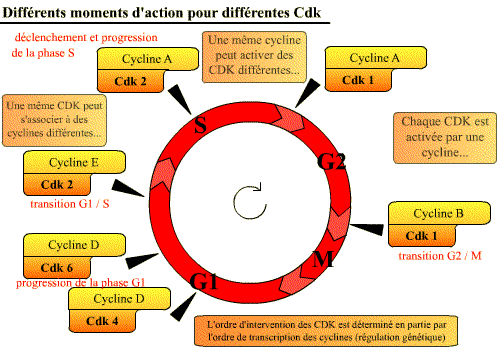
Complexes Cycline / Cdk et cycle cellulaire. Au cours du cycle
cellulaire, six complexes Cycline / Cdk interviennent. [Cliquez
sur la figure pour accéder à une explication
animée]
Actions des différents complexes Cycline / Cdk au cours du cycle cellulaire
Les complexes Cycline / Cdk assurent le bon déroulement du cycle cellulaire, permettant le passage d’une phase à l’autre du cycle et permettant la réalisation des événements du cycle, par le biais de l'activité kinase des Cdk :
|
Moment du cycle
|
Complexe Cycline / Cdk
|
Effets du complexe
|
|
G1
|
Cycline D / Cdk4 et Cycline D / Cdk 6 |
|
|
G1/S
|
Cycline E / Cdk 2
|
|
|
S
|
Cycline A / Cdk 2
|
|
|
G2/M
|
Cycline B / Cdk 1
|
|
Comme l'illustre ce tableau, l'activité de chacune des Cdk n'est pas constante au cours du cycle cellulaire : les Cdk peuvent donc être activées ou inhibées.
Les Cdk sont présentes avant qu'elles ne soient requises. Comment alors
leur activité enzymatique apparaît-elle et disparaît-elle
aux moments opportuns ?
- C'est, premièrement, grâce aux cyclines : les
cyclines n'ont pas d'activité enzymatique par elles-mêmes, mais
se lient aux kinases du cycle pour les rendre actives. L'activité des
Cdk est donc contrôlée par un cycle de synthèse/dégradation
de leur cycline associée, tout au long du cycle cellulaire.
- Deuxièmement, des protéines déphosphorylant
(Cdc 25) ou phosphorylant (CAK,
Wee-1) les Cdk permettent de compléter le contrôle de l’activité
des Cdk.
Nous verrons qu'une phosphorylation peut être activatrice ou inhibitrice.
- Troisièmement, des protéines inhibitrices, les CKI (Cdk Inhibitor), qui ne régulent que négativement
Les Cdk sont activées, par :
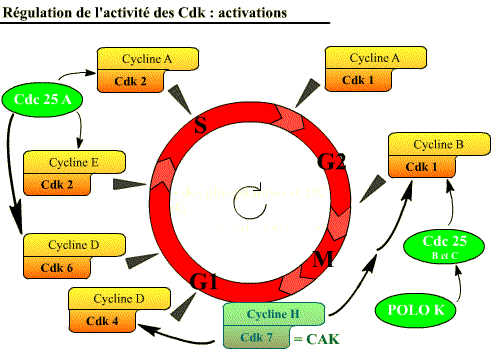
En plus de leur activation par association avec les cyclines, les Cdk peuvent
être activées par diverses protéines :
Des phosphatases (Cdc 25) [déphosphorylations activatrices] et des kinases
(Cycline H / Cdk , et Polo K) [phosphorylations activatrices]. [Cliquez
sur la figure pour accéder à une explication
animée]
Les Cdk sont inhibées par :
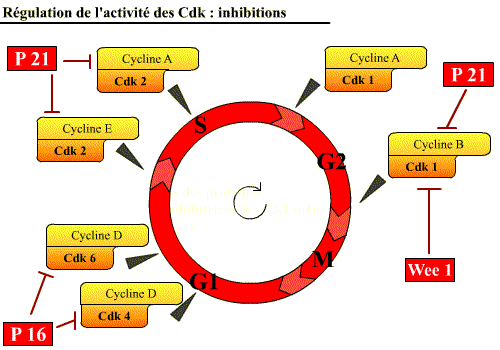
Les Cdk peuvent être inhibées par diverses protéines :
des protéines inhibitrices, les CKI (p16 et p21) et des kinases (Wee
1) [phosphorylations inhibitrices]. [Cliquez sur la figure
pour accéder à une explication
animée]
Schéma complet intégrant les activations et les inhibitions : [cliquez pour un agrandissement] |
Structure tridimensionnelle et activation des Cdk : comment les sites de reconnaissance de la protéine cible et de l'ATP s'ouvrent et se ferment
Toutes les Cdk présentent une structure tridimensionnelle similaire, caractérisée par l'existence de deux poches de fixation :
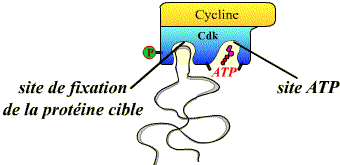
Les deux sites de reconnaissance de la protéine et de l'ATP.
Pour pouvoir agir, les Cdk doivent présenter une conformation où ces deux poches sont accessibles. Les activateurs (Cyclines, Cdc 25, CAK) et les inhibiteurs (p16, p21, kinase Wee 1) induisent des changements de conformation des sites pour le substrat et pour l'ATP.
Changement de conformation induit par la liaison de la cycline :
Avant la liaison de la Cdk à la Cycline, le site catalytique de la Cdk est inaccessible pour l'ATP : les boucles PSTAIRE (noms des acides aminés) et T-loop ferment l'entrée du site. Sans cycline la Cdk est inactive.
La liaison de la cycline provoque :
 |
Pour plus d'informations : Université d'Angers : Importance des changements de conformation dans l'activation des cyclin-dependent kinases. http://www.med.univ-angers.fr/discipline/bio_cel/LicenceUE5/Mecanisme/mecanismeCdk.html |
Changement de conformation induit par la CAK :
La CAK phosphoryle la Thréonine 161 qui se situe au sommet de la boucle T et qui est devenue accessible après la liaison de la cycline à la Cdk. Ceci a pour effet un changement de conformation qui dégage l'entrée du site substrat et permet la fixation du substrat sur la Cdk. La phosphorylation de la Cdk par la CAK est donc "activatrice".
Changement de conformation induit par Wee 1 puis par Cdc 25 :
Wee1 phosphoryle la Cdk sur la Thréonine 14 et la Tyrosine 15. Ces phosphorylations provoquent une répulsion électrostatique qui interdit l'entrée de l'ATP dans son site, elles sont donc inhibitrices. et, dans ce cas, même si la Cdk est phosphorylée sur Th 161 par la CAK (elle accepte alors le substrat), elle reste inactive car l'ATP ne peut pas prendre sa place. C'est la raison pour laquelle les phosphorylations inhibitrices dominent la phosphorylation activatrice. Cdc 25, en déphosphorylant Thréonine 14 et Tyrosine Y15, permet à l'ATP d'entrer dans son site, ce qui correspond à l'activation de la Cycline B/ Cdk1
Changement induit par les CKi
Quand la P 21 se lie à la cycline, elle bloque la poche de l'ATP.
La P16 se lie à la Cdk et empêche la fixation de la Cycline.
En bref, on peut retenir trois mécanismes fondamentaux qui interviennent dans la régulation de l’activité des Cdk :
| 1 - Mise en évidence de l'existence d'un contrôle du cycle cellulaire | 5 - Le point de surveillance G2 / M | 9 - Le point de surveillance G1/S |
| 2 - La régulation de la succession des quatre phases du cycle par les Kinases cycline - dépendantes (Cdk) | 6 - Transition métaphase - anaphase et point de surveillance métaphase - anaphase | 10 - La phase S (à venir) |
| 3 - Mécanismes de surveillance contrôlant les transitions G1/S, G2/M et métaphase/anaphase | 7 - Comment une cellule en G0 peut rentrer en G1 | 11 - Conclusion |
| 4 - Le passage de G2 en M, c'est à dire le déclenchement de la mitose (l'entrée en mitose) | 8 - Le passage de G1 à la suite du cycle | |
| |
© Copyright "Biologie et Multimédia" | |
Mise
en ligne : juin 2004 |