| Accueil | B.Mol | Gen | Web |

-
Quand la concentration de Ca2+ cytoplasmique est supérieure à 1 µM, la cellule se contracte. A contrario, quand la concentration intracellulaire est inférieure à cette valeur, la cellule est plutôt dans un état relâché. Il faut donc une hausse de Ca2+ cytoplasmique pour que la cellule se contracte. Cependant, la force de contraction est aussi sous la dépendante d’un phénomène dit de sensibilisation. Cette sensibilisation va provoquer une contraction à un plus faible taux de Ca2+ intracellulaire.
2) Contraction de la CMLV
Le Ca2+ d'origine extracellulaire et/ou sarcoplasmique peuvent être utilisés par la CMLV pour augmenter la concentration cytoplasmique en Ca2+ et ainsi provoquer la contraction de la cellule. Ces deux sources de Ca2+ ont un rôle différent dans le processus de la contraction musculaire et sont dépendantes du mode d’initiation de la contraction. L’augmentation de Ca2+ peut être due à une modification du potentiel de membrane (initiation électromécanique) qui va provoquer l’ouverture de canaux calciques voltage dépendants et permettre l’entrer du Ca2+ extracellulaire. La hausse de Ca2+ peut également résulter de la liaison d’un agoniste à un récepteur spécifique (initiation pharmacomécanique), ce qui augmente le taux de Ca2+ par la libération du calcium des réservoirs intracellulaires (Fig. 2). Ces deux systèmes sont dépendants et agissent en synergie. Dans tous les cas, cette hausse de Ca2+ intracellulaire est très brève, le calcium étant rapidement cytotoxique, par activation des protéases dépendantes du Ca2+ (calpaïne) ou encore des phospholipases ou des endonucléases.
 |
| Figure 2 : Mode d’initiation de la contraction de la CMLV et mécanismes impliqués. Les deux modes d’initiation, électromécanique ou pharmacomécanique, sont étroitement imbriqués. |
2.1.1 Couplage électromécanique : modification du potentiel de membrane2.1.1.1 Potentiel de membrane
En fonction des territoires vasculaires, le potentiel de membrane des cellules musculaires lisses varie entre -45 et -70 mV (Hirst et al., 1989 ; Serebryakov et al., 1992). Deux types de canaux ioniques interviennent dans la modulation du potentiel de membrane dans les CMLV : des canaux K+ et des canaux Cl-, tous deux dépendant du Ca2+. Dans le cas d’une augmentation de la concentration en Ca2+, ces canaux sont activés. Le canal chlore dépendant du Ca2+ va provoquer une sortie de Cl-, et donc une dépolarisation de la membrane plasmique. Au contraire, l’activation par le Ca2+ des canaux potassiques dépendants du Ca2+ provoque une sortie de K+ et donc une hyperpolarisation et par voie de conséquence une diminution du tonus vasculaire.
2.1.1.2 Canaux calciques dépendants du voltage
La modification du potentiel de membrane de 3 mV augmente (dépolarisation) ou diminue (hyperpolarisation) de deux fois l’entrée de Ca2+ par les canaux calciques voltage dépendants. Les études pharmacologiques et électrophysiologiques ont montré qu’il existe six types de canaux calciques voltage dépendants (CCVDs) : les CCVDs de type L, T, N, R, Q et P (Godfraind et Govoni, 1995). Dans les CMLV, deux types sont présents : le type L (" long-lasting ") et le type T (" transient ") (Hurwitz, 1986 ; Bean, 1989 ; Pelzer et al., 1990 ; Tsien et al., 1991). Les canaux de type T sont activés par des dépolarisations moyennes (-30 mV) et sont inactivés rapidement (20 à 60 ms). Les canaux de type L sont activés par de forte dépolarisation, à partir de –40mV, mais leur activation est complète à 0 mV, et ils sont inactivés moins rapidement que les canaux de type T (300 à 600 ms) (Tsien et al., 1991 ; McDonald et al., 1994).
Dans le cas d’un couplage pharmacologique, la hausse de Ca2+ intracellulaire n’est pas due à une dépolarisation de la membrane. Il faut noter cependant que la modification du potentiel de membrane peut apparaître secondairement. Différents mécanismes ont été proposés pour ce couplage pharmacomécanique : le plus important est l’activation de la cascade des phosphatidyl-inositols qui provoque l’augmentation de l’IP3. Un autre, plus controversé, serait une stimulation de l’influx de Ca2+ sans dépolarisation, par augmentation de la probabilité d’ouverture des canaux de type L, ou encore par activation d’un récepteur canal calcique par liaison de son ligand.
2.1.2.1 Voie PLC/IP3
La majorité des vasoconstricteurs provoquent une contraction des CMLV via leur liaison à un récepteur couplé à la PLCβ. La liaison de ce type de ligand provoque dans un premier temps la libération de Ca2+ des compartiments intracellulaires (Chiu et al., 1987 ; Tawada et al., 1987), puis un flux transmembranaire de Ca2+ , mais cela peut varier selon les récepteurs ou les vaisseaux.
 |
| Figure 3 : Mécanisme de la contraction des CMLV. La contraction est principalement due à l’activation d’un phospholipase C (PLC) et à la production d’IP3. |
La PLCβ est une enzyme dont il existe en fait plusieurs isoformes
(Rhee et Choi, 1992). La PLC va former, à partir du phosphatidylinositol
bisphosphate (PIP2) de la bicouche phospholipidique de la membrane,
de l’inositol trisphosphate (IP3) et du Diacylglycerol (DAG)
(Nishizuka, 1995).
L’IP3 libéré va ensuite venir se fixer sur des
canaux calciques récepteurs à l’IP3 (R-IP3) ce
qui va ouvrir le canal et ainsi libérer du calcium selon son
gradient de concentration (Fig. 3) (Chadwick et al., 1990). Ce mécanisme
n’est pas spécifique à la CML, mais est très
ubiquitaire et a été très bien décrit
par Berridge (1993).
Ensuite un mécanisme de libération de calcium induit
par le calcium ou " calcium induced calcium release " (CICR)
va se mettre en place et provoquer une sortie massive de calcium de
ces réservoirs intracellulaires. Des canaux calciques sensibles
au calcium sont activés par le calcium libéré
via les récepteurs canaux sensibles à l’IP3 et
vont déclencher une rapide sortie du calcium du réticulum.
Ce mécanisme a d’abord été mis en évidence
dans le muscle squelettique puis dans le cœur et enfin dans les
CML (Itoh et al., 1982). Cette libération de Ca2+
induite par le Ca2+ fait suite à une activation
des R-IP3 et surtout des récepteurs canaux de la ryanodine
(Fig. 3). Le récepteur canal à la ryanodine (RyR) a
été cloné à partir de CMLV (Herrmann-Franck
et al., 1991).
En réponse à la hausse de Ca2+ intracellulaire
et à la hausse en phosphoinositides, une PKC dépendante
du Ca2+ et des phospholipides est activée. Une fois
activées, les PKC favorisent la contraction des CMLV par phosphorylation
de CCVDs (Schuhmann et Groschner, 1994), mais aussi en sensibilisant
l’appareil contractile. Cette sensibilisation a lieu en phosphorylant
la MLCK (Ikebe et al., 1985) ou la MLC elle-même (Endo et al.,
1982), ou plus vraisemblablement en phosphorylant la protéine
CPI-17 qui va inhiber l’activité de la MLCP. Le rôle
des PKC conventionnelles et nouvelles dans la régulation de
la contraction a été mis en doute, et l’hypothèse
actuelle penche plutôt vers un rôle des PKC atypiques,
activées par l’acide arachidonique (AA).
L’activité des PLA2s est dépendante du Ca2+
et elles vont jouer un rôle dans la contraction de la CMLV en
libérant suite à leur activation de l’AA dans ces
cellules. L’AA va avoir un rôle dans la sensibilisation
de l’appareil contractile, notamment en activant la PKC (Fig.
4). De plus l’AA va activer la PLCβ et favoriser ainsi l’accumulation
de Ca2+ intracellulaire.
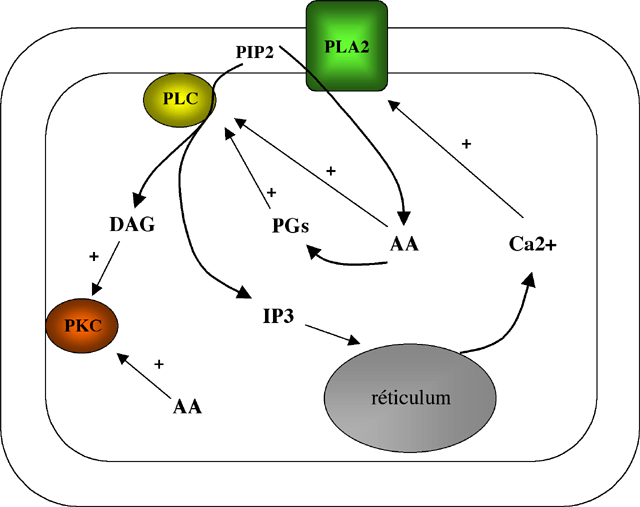 |
| Figure 4 : Interférence de l’activité phospholipasique A2 (PLA2) avec la phospholipase C (PLC) et la protéine kinase C (PKC). L’acide arachidonique (AA) produit par la PLA2 va activer la PLC et la PKC. La PLA2 est activée par le Ca2+ intracellulaire. |
Le Ca2+ dans le milieu intracellulaire va ensuite se complexer avec différentes molécules dont la calmoduline, et former ainsi des complexes Ca2+/calmoduline (une molécule de calmoduline pour quatre ions calciques) (Watterson et al., 1980 ; Means et al., 1991). La calmoduline est une protéine ubiquitaire et multi-fonctionelle, extrêmement conservée au cours de l’évolution. La fixation réversible du Ca2+ induit un changement de conformation de la molécule qui va pouvoir interagir avec la kinase de la chaîne légère de la myosine (MLCK).
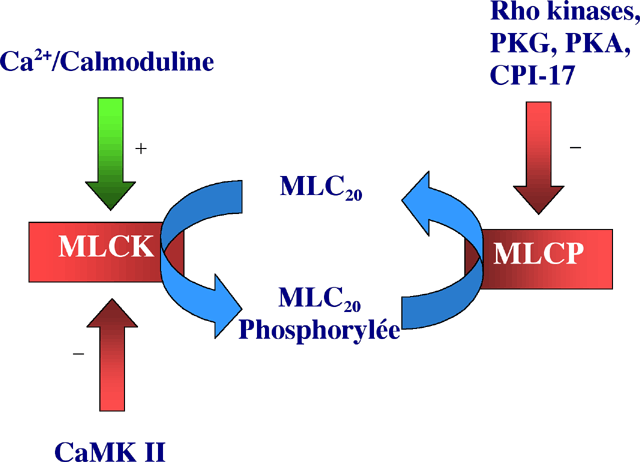 |
| Figure 5 : Activité de la phosphatase (MLCP) et de la kinase (MLCK) de la chaîne légère de la myosine (MLC) dans les CMLV. En ce qui concerne la MLCK, cette activité est régulée par le complexe Ca2+/calmodulline et une kinase dépendante de ce complexe (CaMKII). La MLCP est régulée par différentes kinases et protéines. |
2.2.1 Activation de la MLCK
Le complexe Ca2+/calmoduline une fois formé, va
activer une kinase (MLCK) qui est une enzyme appartenant à
ce complexe enzymatique (Fig. 5). Cette enzyme va phosphoryler la
chaîne légère de la myosine (MLC pour Myosin Light
Chain) sur la Sérine 19. Ce processus de phosphorylation joue
un rôle central dans de nombreux processus biologiques.
La phosphorylation de la MLC est nécessaire à l’interaction
actine-myosine et donc à la contraction de la CML (Ikebe et
al., 1987). L’activité de la MLCK est dans la CML en concurrence
avec une phosphatase : la MLCP (Myosin Light Chain Phosphatase) qui
va déphosphoryler la chaîne légère de la
myosine et ainsi provoquer la rupture de l’interaction actine-myosine.
Contrairement à la MLCK, l’activité de la MLCP
est indépendante de la concentration en calcium.
2.2.2 Appareil contractile de la CML
Les filaments épais sont constitués principalement
de myosine. La myosine possède une activité enzymatique
ATPase nécessaire à sa fonction motrice. La phosphorylation
des chaînes légères régulatrices (MLC20)
provoque un changement de conformation de la myosine qui passe dans
une conformation plus allongée et capable de se lier avec l’actine
(myosine activée).
Les filaments fins sont constitués principalement d’actine.
Les autres protéines constituant le filament fin sont la tropomyosine,
la caldésmone et la calponine. Cependant il n’y a pas
de troponine C, constituant essentiel du filament fin des cellules
musculaires squelettiques et cardiaques. Cela représente la
différence majeure entre les CML et les autres types de cellules
musculaires.
Le mécanisme général de la contraction est le
même que celui des cellules musculaires squelettiques. La fixation
de la myosine activée (qui a lié une molécule
d’ATP) sur l’actine provoque un changement de conformation
de la myosine qui va " pivoter " et provoquer un glissement
des filaments fins par rapport aux filaments épais. La force
nécessaire est produite par l’activité ATPasique
intrinsèque de la myosine. Ce changement de conformation va
également libérer l’ADP et permettre la fixation
d’un nouvel ATP.
Deux mécanismes semblent impliqués dans ce phénomène
de sensibilisation de l’appareil contractile : l’inhibition
de la MLCP et la phosphorylation de protéines régulatrices
(Fig. 5 & Fig. 6).
Plusieurs messagers intracellulaires peuvent modifier l’activité
de la MLCP dont le DAG ou l’acide Arachidonique (AA). Divers
agonistes sensibilisants stimulent la production d’AA via l’activation
de la phospholipase A2 (PLA2). Le DAG et l’AA activeraient une
PKC qui inhiberait l’activité de la MLCP par phosphorylation
de la protéine CPI-17 (Fig. 6), une protéine spécifique
du muscle lisse et inhibitrice de la MLCP (Eto et al., 1995 ; Kitazawa
et al., 1999). L’effet sensibilisant des agonistes vasoconstricteurs
implique les protéines G dont principalement une petite protéine
G : Rho. Celle-ci activerait une protéine kinase : la kinase
associée à Rho (ROK). ROK phosphoryle la MLCP, ce qui
inhibe son activité (Feng et al., 1999 ; Kimura et al., 1996).
ROK pourrait être activée directement par l’AA (Feng
et al., 1999). L’AA pourrait en plus directement inhiber la MLCP
par dissociation de ces sous-unités (Gong et al., 1992).
La phosphorylation de protéines régulatrices associées
aux filaments fins d’actine telles que la Caldésmone et
la Calponine participe à la variation de sensibilité
au Ca2+. Cette phosphorylation lève l’inhibition
de ces molécules sur l’activité de la myosine.
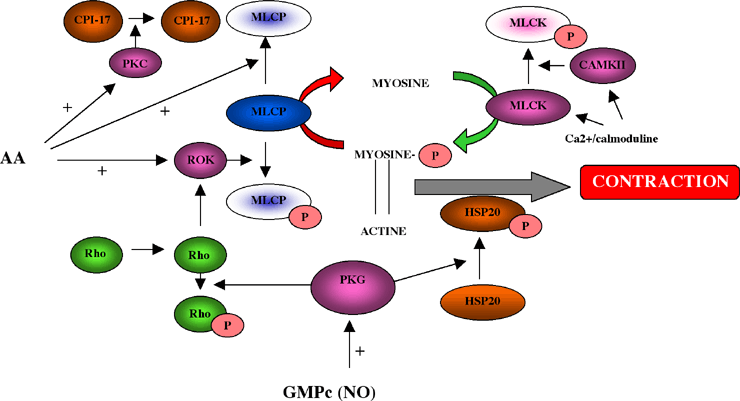 |
| Figure 6 : Sensibilisation et désensibilisation de la CMLV. Les mécanismes de sensibilisation sont principalement axés sur l’inhibition de l’activité de la MLCP, principalement par l’acide arachidonique (AA). La désensibilisation a pour effecteur principal la PKG et pour cible la kinase Rho dépendante (ROK) et la protéine HSP20. |
On peut distinguer deux types de relaxation : une relaxation passive, par retrait d’un agent vasoconstricteur, et une relaxation active, par effet d’un vasodilatateur. Dans le premier cas, ce sont les mécanismes d’homéostasie du Ca2+ intracellulaire qui vont diminuer ce taux. Ce sont les pompes calciques membranaires et les SERCAs qui dans ce cas vont induire une relaxation et un retour à l’état basal. Dans le cas de l’action d’un vasodilatateur, la vasorelaxation peut être induite par trois mécanismes distincts : la baisse du Ca2+ intracellulaire, la baisse de la sensibilité au calcium de l’appareil contractile et l’action directe sur les protéines du cytosquelette. De plus, la corrélation entre le taux de Ca2+ et la contraction n'est pas permanente : le calcium intracellulaire est très rapidement cytotoxique à des molarités élevées. Il faut donc que la CMLV diminue rapidement ce taux après la contraction. Cependant, les CML sont le plus souvent impliquées dans des fonctions qui réclament des contractions prolongées. Il existe donc des mécanismes qui permettent à la CML de rester contractée en absence de Ca2+.
| A- Localisation, structure et fonction
des CMLV B- Mécanisme de la relaxation/contraction de la CMLV C- Régulation de la contraction/relaxation de la CMLV Bibliographie |
1) Homéostasie du calcium intracellulaire
: état basal 2) Contraction de la CMLV 3) Relaxation de la CMLV |