|

-
Le xenope, animal de laboratoire (Elevage et fécondation)
Michel Delarue et Christophe Arnoult
- Xenopus laevis, le crapaud à griffe ou dactylère
du Cap, originaire d'Afrique australe, est un amphibien anoure de la
famille des pipidae. Il possède un mode de vie essentiellement
aquatique, ne remontant à la surface de l'eau que pour respirer.
Les femelles adultes mesurent une dizaine de centimètres du museau
à l'anus (Fig.1).

- Les mâles sont toujours plus petits que les femelles. Parmi les caractéristiques de ces animaux, on note des pattes postérieures très musculeuses et garnies d'une large palmure. Cette disposition anatomique en fait d'excellents et puissants nageurs. De plus, les trois doigts internes des pattes postérieures portent des griffes cornées (Fig.2). (Pour voir l'animation cliquez sur la figure 2).
-

- La coloration de la peau est extrèmement variable d'un individu à un autre (Fig.3 et 4) et peut être modulée par l'éclairement de l'environnement et du substrat. Des souches albinos existent également (Fig.5).
-



-
Elevage en laboratoire - Les adultes
- Le mode de vie aquatique de ces animaux favorise leur élevage en laboratoire. A l'inverse de la plupart des autres amphibiens qui nécessitent l'aménagement d'un aquaterrarium, le xenope se satisfait d'un simple aquarium ou d'un bac dans lequel il vit en pleine eau. La contenance minimum d'un bac pour maintenir une quinzaine de femelles doit être de l'ordre de 50 litres (Fig.6).
-

- Chaque bac doit être recouvert d'un couvercle grillagé
pour empêcher la fuite des animaux (leurs pattes musculeuses leur
permettent de sauter hors des bacs) (Fig.7).
-

L'eau d'élevage doit être dépourvue de chlore et la température maintenue à 22°C. Il est préférable de consacrer à l'élevage, une pièce thermostatée à 24°C de façon à corriger la déperdition de chaleur de l'eau des bacs. Cette pièce sera éclairée par un plafonnier en tubes fluorescents type Néon blanc Mazda Fluor SF36W/AZU965. L'alternance nycthémérale de l'éclairage sera assurée par une horloge avec une périodicité de 12h/12h.
- On peut concevoir un planning hebdomadaire pour le maintien des adultes
en élevage au laboratoire.
- Lundi
Matin : alimentation ; saupoudrage d'aliments complets pour poisson sous forme de granulés "Aqualife" N°6.
Après-midi : Nettoyage ; les animaux de chaque bac sont tour à tour retirés et stockés temporairement à part. Les bacs sont vidés, nettoyés, grattés sans détergent à l'aide d'une éponge type "scotch brite", rincés abondamment et remplis avec une eau à 22°C. L'eau est délivrée à la bonne température grâce à un ballon chauffe-eau thermostaté. Les animaux sont replacés dans leur bac d'origine.
Mardi
Matin et après-midi : repos des animaux, pas de renouvellement d'eau.
Soir : distribution de granulés.
Mercredi
Matin : nettoyage ; même protocole que pour le lundi après-midi.
Après-midi : repos des animaux,pas de renouvellement d'eau.
Jeudi
Matin et après-midi : repos des animaux, pas de renouvellement d'eau.
Soir : distribution de granulés.
Vendredi
Matin : nettoyage, même protocole que pour le lundi après-midi.
Après-midi : repos des animaux, pas de renouvellement d'eau.
Samedi et Dimanche : repos des animaux, pas de renouvellement d'eau.
Les têtards
Dès que les larves sont capables de se nourrir, elles sont placées dans des aquariums à raison de 10 têtards par litre d'eau déchlorée (ou mieux, de l'eau de source) aérée par un bulleur. Les têtards sont microphages. Ils filtrent les boues déposées sur le fond de l'aquarium. Ces boues sont constituées par des décoctions d'orties séchées ou des poudres de potage du commerce (Knorr). On peut également ajouter un peu de levure de boulanger. Pendant leur activité de filtrage, les têtards adoptent une position stationnaire, le corps oblique, la tête tournée vers le fond de l'aquarium (Fig.8). Seule l'extrémité de la queue est animée d'un battement rapide pour maintenir l'inclinaison du têtard. (Pour voir l'animation cliquez sur la figure 8)
-

Ces derniers atteignent la métamorphose deux mois et demie après la ponte. Pendant cette période les animaux ne se nourrissent plus. La métamorphose achevée, les jeunes grenouilles se nourrissent de proies vivantes adaptées à leur taille qui est de l'ordre du centimètre. Ce sont principalement des larves de chironomes couramment vendues dans les boutiques spécialisées en aquariophilie.
L'élevage en laboratoire peut conduire à l'obtention d'animaux adultes. La maturité sexuelle apparaît environ un an après la fécondation pour une femelle et six mois pour un mâle. Cependant, il est préférable d'attendre un an et demie pour une femelle et un an pour un mâle pour des raisons de dimension des animaux et de quantités d'oeufs utilisables.
Pathologies
Elles sont peu nombreuses. Le xénope est plutôt
résistant aux agents infectieux connus chez les amphibiens. Les
atteintes bactériennes, fongiques ou parasitaires sont les plus
communes. L'infection la plus répandue est la "red leg septicemia"
qui se manifeste par des lésions cutanées, des oedèmes
sous-cutanés et une inflamation du réticule veineux peaucier
notamment au niveau des pattes. Les agents infectieux sont bactériens
tels que Aeromonas et Pseudomonas. Les animaux atteints
doivent être isolés rapidement à cause du caractère
contagieux de l'infection.
Le traitement consiste en l'addition de tétracycline dans l'eau d'élevage à raison de 100mg.mL-1 pendant une semaine.
Les atteintes fongiques peuvent survenir sur d'éventuelles plaies
cutanées. Le traitement consiste en l'adjonction de produits antifongiques
(vendus en aquariophilie), dans l'eau d'élevage.
D'une manière générale, la moindre plaie externe
peut être traitée par un bain antiseptique à base
d'éosine (Fig.9).
-

L'une des méthodes les plus simples est de couper des griffes aux trois doigts internes des pattes postérieures et de convenir d'un code tenant compte des différentes combinaisons, comme de lire les dizaines sur la patte de gauche et les unités sur celle de droite. L'inconvénient est que les griffes repoussent en quelques mois, ce qui nécessite d'entretenir le marquage. La méthode la plus sure est d'effectuer des autogreffes de la peau ventrale sur le dos de l'animal. Bien qu'un peu lourde à mettre en oeuvre, cette méthode présente l'avantage de réaliser un marquage permanent et de varier les combinaisons en fonction de la forme des greffons et de leur lieu d'implantation.
Reproduction
Préparation des géniteurs
Le succès des amphibiens pour l'étude du développement
embryonnaire tient aux dimensions importantes des oeufs (entre 1 et 2
mm de diamètre), à leur développement externe qui
le rend aisément accessible à l'observateur et au grand
nombre d'oeufs pondus comme chez le Xenope (plusieurs centaines).
De plus, les embryons peuvent être obtenus artificiellement en induisant
l'ovulation puis en pratiquant la fécondation in vitro.
Ovulation
L'ovulation peut être obtenue artificiellement avec des
hormones gonadotropes du commerce. Afin de garantir le succés de
cette opération, il est préférable de préparer
plusieurs femelles. Celles-ci peuvent être stimulées tous
les 3 mois dans des conditions d élevage et d'alimentation optimum.
L'ovulation est induite par l'injection d'hormone gonadotrope chorionique
(Chorionic Gonadotropin, Sigma, 10.000 I.U. per vial, code CG-10) dans
les sacs lymphatiques dorsaux. Selon le poids de l'animal, 500 à
700 unités d' hCG diluée dans un soluté de type sérum
physiologique, sont injectées .
-

Afin d'éviter le reflux il est conseillé de piquer l'aiguille dans le haut de la cuisse à travers un septum et de serrer le lieu d'injection pendant quelques secondes au moment de retirer l'aiguille.
Des glandes cutanées secrètent un mucus abondant qui enduit la peau et rend les animaux extrèmement glissants. Pendant toute cette manipulation, il est donc recommandé de tenir l'animal avec un chiffon sec pour éviter qu'il ne s'échappe (Fig.11).
Les femelles en stimulation sont ensuite remises séparément
dans un aquarium situé à l'écart et recouvert d'un
couvercle faisant écran, dans une pièce isolée du
passage des personnels afin d'éviter toute forme de stress qui
risquerait de compromettre le succès de la ponte. Dans ces conditions,
les animaux commencent à pondre une douzaine d'heures après
la piqûre, à la température ambiante de 22°C.
Des oeufs peuvent ainsi être obtenus tout au long de la journée,
soit entre 6 et 10 heures.
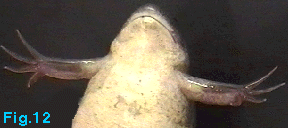
Spermatogenèse
Elle est naturellement productive chez les mâles pourvus de
caractères sexuels secondaires bien visibles tels que les callosités
noirâtres des membres antérieurs (voir Fig. 12). Dans le
cas contraire la spermatogenèse peut être stimulée
chez le mâle par stimulation hormonale (deux injections d'hormone
gonadotrope 50 I.U. à 24 heures d'intervale)
Fécondation naturelle
Dans leur nature d'origine, les xenopes se reproduisent pendant
le printemps austral. Dans nos régions ils peuvent s'accoupler
naturellement en été et en automne à condition qu'ils
trouvent des conditions d'élevage pseudonaturelles dans des aquariums
extérieurs (substrat graveleux, plantes aquatiques, nourriture
abondante...). La reproduction peut être stimulée par un
traitement hormonal approprié (voir "Préparation de
géniteurs").
Une fois stimulés, les animaux présentent des caractères sexuels secondaires. Les mâles à maturité portent des épaississements épidermiques pigmentés, kératinisés et rugueux sur la surface interne des membres antérieurs. Ce sont les callosités qui servent au mâle pour s'accrocher à la femelle au moment de l'accouplement (Fig.12).
Les femelles possèdent deux papilles turgescentes qui encadrent le cloaque (Fig.13).
L'amplexus est lombaire et la ponte peut durer plusieurs heures (Fig.14).
La femelle expulse périodiquement des grappes de plusieurs dizaines
d'ovocytes que, le mâle arrose de sa semence simultanément.
Les oeufs fécondés peuvent être ainsi récoltés
aisément sur le fond du bac à l'aide d'une pipette en verre
avec une embouchure supérieure à 2 mm de diamètre.
Cette méthode présente l'avantage d'être naturelle
et ne nécessite pas de prélèvement chirurgical. Elle
est conseillée pour une simple observation à usage éducatif.
Fécondation in vitro
A mesure que les ovocytes transitent par les voies génitales
femelles, ils sont transitoirement accumulés dans la région
distale de l'oviducte renflée. Il est alors possible de les récolter
environ toutes les heures par lots de quelques dizaines voire une centaine.
Pour ce faire, il faut saisir la femelle à pleine main de façon
à la maintenir en contention tout en dirigeant le cloaque vers
la coupelle où les oeufs doivent être déposés.
(Pour voir l'animation cliquez sur la figure
15).
Cette manipulation, plutôt délicate, necessite de la dextérité et un peu d'habitude. Les oeufs sont entourés d'une gangue mucilagineuse qui colle au fond de la coupelle (Fig.16).
La fécondation peut être effectuée selon deux protocoles
différents :
1- en effectuant un broyat
à partir de biopsies testiculaires dans un milieu de culture pour
amphibien (MBS: Modified Barth's Saline). Quelques gouttes de ce milieu
de culture sont déposées sur les oeufs (Fig.17).
Le milieu peut être conservé au réfrigérateur
pendant quelques heures.
2 - en appliquant
sur la surface des oeufs, des fragments de biopsie testiculaire. La section
du testicule libère des spermatozoÏdes fécondants.
Cette dernière méthode permet de conserver les fragments
testiculaires plusieurs jours au réfrigérateur dans le milieu
de culture. Les spermatozoïdes restant dans les tubes séminifères
se conservent plus longtemps que dans la première méthode.
Dès que les spermatozoïdes sont en contact avec les oeufs,
la coupelle est agitée énergiquement dans le plan horizontal
(Fig.18) afin d'étaler les oeufs en une monocouche
sur le fond de la coupelle (Fig.19).
Environ 10 minutes après l'application des spermatozoïdes,
la coupelle est remplie de MBS 0.1X.
Les premiers signes de la fécondation s'observent dans les 20 minutes
qui suivent l'entrée du spermatozoïde (voir "De
l'oeuf à la grenouille").
L'avantage de cette technique réside dans le fait que l'on peut
obtenir des lots d'oeufs fécondés au même moment et
qui se développent de manière synchrone. Ceci est nécessaire
dans le cadre de recherches fondamentales effectuées en laboratoire.
Gestion des femelles
Les femelles ayant pondu sont stockées dans un aquarium à part des femelles prêtes à pondre. Il est recommandé de les marquer et d'enregistrer sur un répertoire d'élevage, la date de ponte, la quantité d'oeufs produits, les pourcentages de fécondation et de développement. Ces données assurent la traçabilité des animaux. Une femelle ayant fourni des pontes en quantité et en qualité peut ainsi être suivie et remise à pondre tous les trois mois. Il est également conseillé de ne pas réutiliser les femelles dont la médiocrité des résultats est répétitive.
Attention!
La fécondation in vitro nécessite
une biopsie du mâle. Bien qu'aisément réalisable sur
un amphibien, une biopsie est cependant un acte chirurgical qui requiert
légalement une habilitation.
Celle-ci
est accordée pour des laboratoires de recherche. Par contre, dans
le cadre d'un établissement d'enseignement secondaire (lycées
et collèges), la réalisation de la fécondation et
l'observation du développement embryonnaire ne peuvent se concevoir
qu'après accouplement des géniteurs stimulés ou pas,
par des hormones gonadotropes (voir "Fécondation naturelle").
Appendice
MBS (Modified Barth's Medium)
On prépare deux solutions :
A-0.1M CaCl2
B-MBS 10X (NaCl/KCl/MgSO4)
A-0.1mol. L-1 CaCl2
11.1g/litre
stériliser et stocker en aliquots à -20°C
B-MBS 10X
NaCl 880 mmol. L-1
KCL 10 mmol. L-1
MgSO4 10 mmol. L-1
HEPES 50 mmol. L-1
NaHCO3 25 mmol. L-1
Ajuster le pH à 7.8 avec de la soude 1 mol. L-1.
Stériliser.
La solution de MBS normale s'effectue en mélangeant 7mL de la solution
A avec 100mL de la solution B. Ajuster à 1 litre avec de l'eau
distillée. Pour éviter tout risque d'infection, il est conseillé
d'ajouter un antibiotique (gentamycine) à raison de 50 mg.mL-1.